Gegen wenige Erreger ist die Impstoff-Entwicklung derzeit so in Bewegung, wie gegen RSV.
Die Entwicklung von RSV-Impfstoffen steht für eine der größten Katastrophen der Impfstoff-Entwicklung: ein in den 1960er-Jahren entwickelter, Formaldehyd-inaktivierter RSV-Impfstoff (FI-RSV) zur aktiven Immunisierung vermittelte nicht nur keinen Schutz vor der Infektion mit dem RSV, es kam zusätzlich zu einer dramatischen Zunahme schwerer und schwerster RSV-Verläufe vor allem bei den Geimpften, die vorher keinen Wild-RSV-Kontakt hatten und von denen teilweise 80% im Krankenhaus behandelt werden mussten (im Vergleich zu 5% der Kontrollgruppe). Mindestens zwei Kinder starben im Rahmen dieser Studien, bei beiden konnte RSV in den unteren Atemwegen nachgewiesen werden. "The mechanisms responsible for the FI-RSV vaccine-associated disease enhancement are still not completely understood.“ (Karron 2018)
Einer der Erklärungsansätze ist das Entwickeln unzureichend neutralisierender Serum-Antikörper und das Fehlen schützender Schleimhaut-Antikörper (denen bei RSV eine große Bedeutung zukommt - s. RSV - Die Erkrankungen) nach der Impfung.
Daher verfolgt die Entwicklung von Impfstoffen zu aktiven Immunisierung, die direkt bei Säuglingen und Kleinkindern als der am stärksten durch schwere Krankheitsverläufe gefährdeten Gruppen, angewendet werden sollen, derzeit vor allem Ansätze mit Lebend- oder Vektorimpfstoffen.
Palivizumab
Palivizumab enthält monoklonale Antikörper gegen das F-Oberflächenprotein von RSV (das verglichen mit dem G-Protein eine deutlich höhere (anti-)genetische Stabilität aufweist).
Die zur Zulassung führenden Studien an Frühgeborenen mit relevanter Lungenvorschädigung und/oder angeborenen Herzfehlern zeigten zwar eine Verringerung der Hospitalisierungsrate, aber keinen Einfluss auf den Schweregrad der Krankheitsverläufe oder die Sterblichkeit (DGPI 2018).
Die Deutsche Gesellschaft für pädiatrische Infektiologie empfiehlt daher in einer Leitlinie aus dem Jahr 2018 (die 2023 überarbeitet wird) den Einsatz nur für definierte Risikogruppen wie extreme Frühgeborene oder Früh- und Neugeborene mit pulmonalen und/oder kardialen Risikofaktoren (AWMF 2018).
Im Falle einer Prophylaxe sollte lt. DGPI die erste Dosis zu "Saisonbeginn" Anfang November und weitere Dosen dann im Abstand von jeweils 4 Wochen verabreicht werden.
Nirsevimab
Im Herbst 2022 ließ die EMA Nirsevimab (Beyfortus®) zur Prophylaxe von RSV-Infektionen bei Neugeborenen und Kindern in ihrer ersten RSV-Saison zu. Anders als bei Palivizumab ist hier also eine Anwendung bei allen Neugeborenen und Säuglingen - nicht nur bei Hochrisikokindern - vorgesehen.
Auch Nirsevimab ist ein monoklonaler Antikörper, der mittels rekombinanter DNA-Technologie aus Hamster-Eierstöcken gewonnen wird und der - wie Palivizumab - an das F-Protein des RSV bindet, wodurch das Eindringen freier Virionen in die Zellen sowie die Ausbreitung des zellassoziierten Virus durch Zellfusion verhindert wird (PZ 2022).
Der wesentliche Vorteil von Nirsevimab verglichen mit Palivizumab liegt in seiner deutlich längeren Wirksamkeit: eine intramuskuläre Injektion wird als ausreichend schützend für die erste RSV-Saison angesehen. Daten zu Sicherheit und Wirksamkeit von Wiederholungsinjektionen liegen nicht vor (EMA 2022).
Das deutsche Institut für Qualität und Wirschaftlichkeit im Gesundheitswesen IQWIG sieht in einer aktualisierten Einschätzung einen "beträchtlichen" Zusatznutzen der Impfung auf für Säuglinge ohne Vorerkrankungen bezogen auf die Häufigkeit schwerer RSV-Infektionen der unteren Atemwege (IQWIG 2025). Es gibt allerdings deutliche Schönheitsfehler dieser Einschätzungen:
-
der Schutzeffekt vor RSV-Infektionen der unteren Atemwege unabhängig von ihrer Schwere war nur für Säuglinge in den ersten 6 Lebensmonaten signifikant - die STIKO empfiehlt die Impfung aber auch für ältere Säuglinge in ihrer jeweils "1. RSV-Saison"
-
der Schutzeffekt vor schweren RSV-Infektionen mit Hospitalisierung war sogar nur für Säuglinge bis zu einem Alter von 3 Monaten signifikant (a-t 2024).
-
in der Nirsevimab-Gruppe gab es insgesamt 5 Todesfälle (Levi 2025) (keinen in der Placebogruppe), die angesichts der großen Studie jedoch keine statistische Signifikanz erreichten. Es stellt sich allerdings mit Nachdruck die Frage, ob die statistische Signifikanz hier das entscheidende Kriterium ist.
-
in der nicht verblindeten HARMONIE-Studie des Herstellers gab es ein beunruhigendes Signal bezüglich schwerer neurologischer Nebenwirkungen (11 in der Impf- verglichen mit 2 in der Placebogruppe), darunter 2 Fälle schwerer Epilepsie (Levi 2025)
Nach einer eigenen Analyse der aktuellen europäischen Impfempfehlungen (Stand April 2025) empfehlen bislang nur 3 europäische Staaten (A, D, E) die RSV-Prophylaxe pauschal für alle Säuglinge - die sonst hilfreiche Übersicht der ECDC listet hier auch im Juli 2025 noch kein einziges Land.
Nach dem Desaster um Formaldehyd-inaktivierte RSV-Impfstoffe bei Kindern fokussierte sich die Impfstoff-Entwicklung lange auf Impfstoffe für ältere Erwachsene (die ebenfalls durch schwerere RSV-Verläufe gefährdet sind aber in ihrem Leben schon eine vorbestehende Immunität aufgebaut haben) und Schwangere (die ebenfalls eine vorbestehende Immunität gegen RSV aufweisen und nach der Impfung ihren Neugeborenen einen Nestschutz gegen RSV-Infektionen vermitteln sollen).
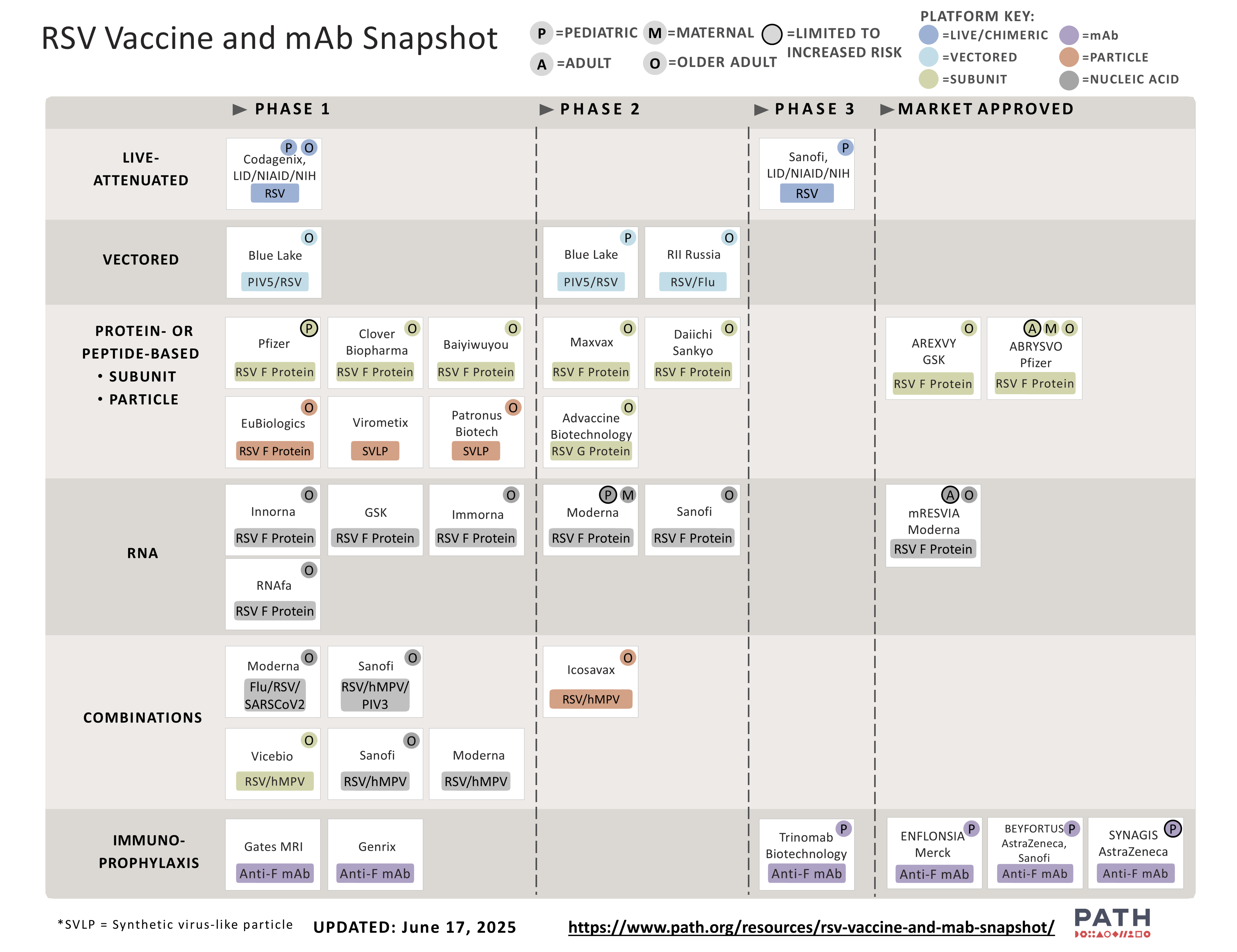
Eine gute Übersicht findet sich bei path.org - die beiden Präparate zur Immunoprophylaxe sind oben besprochen:
Hier die Version aus dem Juni 2025 (Path 2025)
AREXVY (RSVPreF3 OA - GSK)
Proteinbasierter Impfstoff mit ASO1 (Wirkverstärker auf Lipid/Saponin-Basis) als Adjuvans.
Die Zwischenauswertung einer placebokontrollierten Phase III-Studie mit insgesamt 26.000 Teilnehmern über 60 Jahre ergab eine Impfstoff-Effektivität (relative Risikoreduktion RRR) von 82,6% für das Verhindern einer bestätigten RSV-Infektion der unteren Atemwege über 6,7 Monate Beobachtungszeit. Die absolute Risikoverringerung ARR betrug 0,26%, die Anzahl der Menschen, die geimpft werden müssen um im Beobachtungszeitraum einen solchen Erkrankungsfall zu verhindern betrug 379 (NNV) (Papi 2023).
Den von GSK behaupteten Einfluss auf schwere RSV-Infektionen lässt die EMA so nicht gelten, da sie die von GSK verwendeten Definitionen für ungeeignet hält (EMA 2023).
Die Verträglichkeit des Impfstoffs ist schlecht, 49% der Geimpften klagen über systemische Nebenwirkungen (23% unter Placebo), 3% über schwere systemische UAW (1% unter Placebo). Unter den Geimpften tritt ein Fall eines Guillain-Barré-Syndroms auf (neun Tage nach der Impfung, zwei Impflinge, die parallel noch eine Influenza-Impfung erhielten, erkrankten an einer akut disseminierenden Enzephalomyelitis (ADEM - eine schwere Hirnentzündung ähnlich der MS), einer von ihnen starb. Die FDA hält einen Zusammenhang zu vermehrt beobachteten Herzrhythmusstörungen (Vorhofflimmern) für möglich (FDA 2023a).
Das industrieunabhängige arznei-telegramm sieht für ABRYSVO und AREXVY derzeit einen Einsatz "allenfalls im Einzelfall nach sorgfältiger Aufklärung über die potentiellen Risiken und offenen Fragen für ältere Personen" und hält den identischen Preis von € 214 pro Dosis für "unverhältnismäßig hoch" (a-t 2023). Die mittlerweile von der STIKO ausgesprochene Impfempfehlung für Ältere kommentiert das a-t "Wir halten die Immunisierung älterer Erwachsener gegen RSV beim derzeitigen Kenntnisstand für zweifelhaft." (a-t 2024b)
ABRYSVO™ (RSVpreF - Pfizer)
Zu diesem Impfstoff wurden während der Corona-Pandemie zwei Zulassungsstudien durchgeführt, deren (Zwischen-) Ergebnisse mittlerweile veröffentlicht wurden
Impfung älterer Erwachsener (RENOIR-Studie)
Diese große (n=35.000) Studie der Hersteller-Firma Pfizer (Walsh 2023) untersuchte die Wirksamkeit des Impfstoffs an über 60-Jährigen. Die Impfstoff-Effektivität bezogen auf das Verhindern von Erkrankungen der unteren Atemwege betrug je nach Definition 66,7% bzw. 85,7% bei allerdings jeweils sehr großen Vertrauensbereichen. Trotz ihrer Größe konnte die Studie keinen sicheren Effekt auf schwere Verläufe dieser Erkrankungen oder Todesfälle an RSV-Infektionen, die eigentlich entscheidende Zielgröße, nachweisen (Karron 2023). Die Studie war nicht placebokontrolliert, verwendet wurde die Impfstoff-Formulierung lediglich ohne den Wirkstoff.
Auch wenn die reine Häufigkeit schwerer Nebenwirkungen in der Impfstoff- und Placebogruppe in der gleichen Größenordnung lagen, irritiert, dass in der Impfstoff-Gruppe zwei Fälle schwerer neurologischer Nebenwirkungen (je ein Guillain-Barré- und ein Miller-Fisher-Syndrom innerhalb von maximal 8 Tagen nach der Impfung) auftraten. Auch eine verzögerte Überempfindlichkeitsreaktion, die acht Stunden nach der Impfung auftrat wird selbst von den Studienärzten mit der Impfung in Verbindung gebracht. Die US-amerikanische Arzneimittelbehörde FDA äußert zudem den Verdacht, dass Herzrhythmusstörungen (Vorhofflimmern) durch die Impfung häufiger ausgelöst werden könnten, als durch das "Placebo" (FDA 2023b) - dies soll in Postmarketing-Studien geklärt werden.
Impfung Schwangerer (MATISSE-Studie)
Eine ausführliche Studienanalyse finden Sie hier.
Das industrieunabhängige arznei-telegramm sieht für ABRYSVO und AREXVY derzeit einen Einsatz "allenfalls im Einzelfall nach sorgfältiger Aufklärung über die potentiellen Risiken und offenen Fragen für ältere Personen" und hält den identischen Preis von € 214 pro Dosis für "unverhältnismäßig hoch" (a-t 2023). Die mittlerweile von der STIKO ausgesprochene Impfempfehlung für Ältere kommentiert das a-t "Wir halten die Immunisierung älterer Erwachsener gegen RSV beim derzeitigen Kenntnisstand für zweifelhaft." (a-t 2024b)
mResvia™ (Moderna)
mRNA-Impfstoff, codiert das Prefusions F-Glycoprotein des RSV
Die der Zulassung zu Grunde liegende Studie (Wilson 2023) umfasste insgesamt etwa 35.000 Älter und untersuchte das Auftreten von RSV-Infektionen mit jeweils 2 oder 3 vordefinierten Symptomen. Die absolute Risikoreduktion betrug für Infekte mit 2 Symptomen 0,26%, für solche mit 3 Symptomen 0,08% - im letzteren Fall müssten 1250 ältere Menschen geimpft werden, um eine entsprechende RSV-Infektion zu verhindern. Die Verträglichkeit der Impfung war in dieser Studie eher schlecht 58,7% der Geimpften entwickelten lokale Nebenwirkungen (Placebogruppe: 16,2%), systemische UAWs traten bei 47,7% vergleichen mit 32,9% in der Placebogruppe auf.
Die EMA folgte der US-amerikanischen Zulassungsbehörde FDA auf dem Fuße und ließ mResvia™ schon im August 2024 zu, die STIKO erweiterte ihre Empfehlung der RSV-Impfung Älterer im April 2025 um den mRNA-Impfstoff. In der "Wissenschaftlichen Begründung" muss sie jedoch einräumen, dass zur Mehrzahl der klinisch relevanten Endpunkte (Ärztlich behandelte RSV-Infektionen der unteren Atemwege, Hospitalisierung wegen RSV-Infektionen der unteren Atemwege, ...) lediglich Modellierungen und Schätzungen vorliegen - "Zum jetzigen Zeitpunkt sind uns keine Ergebnisse von Studien bekannt, die die Effektivität der mRNA-RSV-Impfung in der Real-World-Anwendung untersuchen." (RKI 2025).
a-t. 2024. 55: 5-6
a-t. 2024b. 55: 82-4
a-t. 2023. 54: 73-5
AWMF. Prophylaxe von schweren Erkrankungen durch Respiratory Syncytial Virus (RSV) bei Risikokindern. RegNr 048-012
EMA. 2023. AREXVY: EPAR. Abruf 20.10.2023
EMA. 2022. Beyfortus: EPAR - Product Information. Stand 21.03.2023
FDA. 2023a. Clinical Review Memo AREXVY. Abruf 20.10.2023
FDA. 2023b. Summary Review ABRYSVO; Abruf 20.10.2023
GSK. 2022. https://seekingalpha.com/article/4493526-glaxosmithkline-plc-gsk-management-presents-42nd-annual-cowen-health-care-conference.
IQWIG. 2025. https://doi.org/10.60584/A25-33
Karron RA. 2018. RSV. in Plotkin's Vaccines. 7th edition. 2018
Karron RA. 2023. https://www.nejm.org/doi/full/10.1056/NEJMe2302646
Levi. 2025. https://x.com/RetsefL/status/1896971108517339490 (Abruf 02.07.2025)
Muller WJ. 2023. https://www.nejm.org/doi/full/10.1056/NEJMc2214773
Papi A. 2023. https://www.nejm.org/doi/full/10.1056/NEJMoa2209604
Path.org. 2023. https://www.path.org/resources/rsv-vaccine-and-mab-snapshot/
RKI. 2025. EpiBull 15/2025
PZ. 2022. RSV-Prophylaxe Nirsevimab erhält Zulassung für Säuglinge. Abruf 07.04.2023
Walsh EE. 2023. https://www.nejm.org/doi/full/10.1056/NEJMoa2213836
Wilson E. 2023. https://www.nejm.org/doi/10.1056/NEJMoa2307079